¶ I - L'histoire des batteries Lithium-ion
La découverte du principe de fonctionnement des piles à lieu en 1800. C'est Alexendro Volta avec la pile éponyme utilisant deux métaux différents, des disques de zinc et de cuivre, séparés par un feutre imbibé de chlorure de sodium. Il faut ensuite attendre 1859 pour la découverte, par Gaston Planté, du fonctionnement du premier accumulateur rechargeable acide-plomb.
De nos jours, un peu plus de 150 ans plus tard, les technologies d'accumulateurs grand public comprennent seulement trois grandes familles, en plus des accumulateurs plomb-acide : les technologies alcalines nickel-cadmium (Ni-Cd), nickel-hydrure métallique (Ni-MH) et depuis 1991 les accumulateurs lithium-ion (Li-ion).
Deux innovations majeures ont permis d'aboutir à la commercialisation des accumulateurs Li-ion. En 1980, J.Goodenough découvre la potentialité d'utilisation du matériau comme électrode positive à haut potentiel. En parallèle, en 1983, R.Yazami et P.Touzain montrent que le lithium peut s'intercaler de façon réversible dans le graphite à bas potentiel. Il devient alors possible de s'affranchir de l'utilisation du lithium métallique, qui pose de sérieux problèmes de sécurité de fonctionnement. La combinaison de ces deux innovations permet le développement des accumulateurs Li-ion et leur première commercialisation par Sony en 1991.
Depuis la première commercialisation en 1991, la densité d'énergie massique des accumulateurs Li-Ion, qui est d'ailleurs l'un de leurs points forts, a quasiment triplé, passant de 100 Wh/kg en 1991 à 270 Wh/kg pour les meilleurs accumulateurs du marché actuel. Dans le même temps, leur prix a très fortement diminué, du fait de la réduction des coûts de fabrications, ce qui permet aujourd'hui l'essor de cette technologie notamment pour les véhicules électriques.
¶ II - Fonctionnement des batteries Lithium-ion
¶ II.1 - Les propriétés du lithium
Le lithium est le troisième plus petit atome du tableau périodique du classification des éléments (Tableau de Mendeleïev). C'est le plus petit atome présent à l'état solide à la pression atmosphérique.
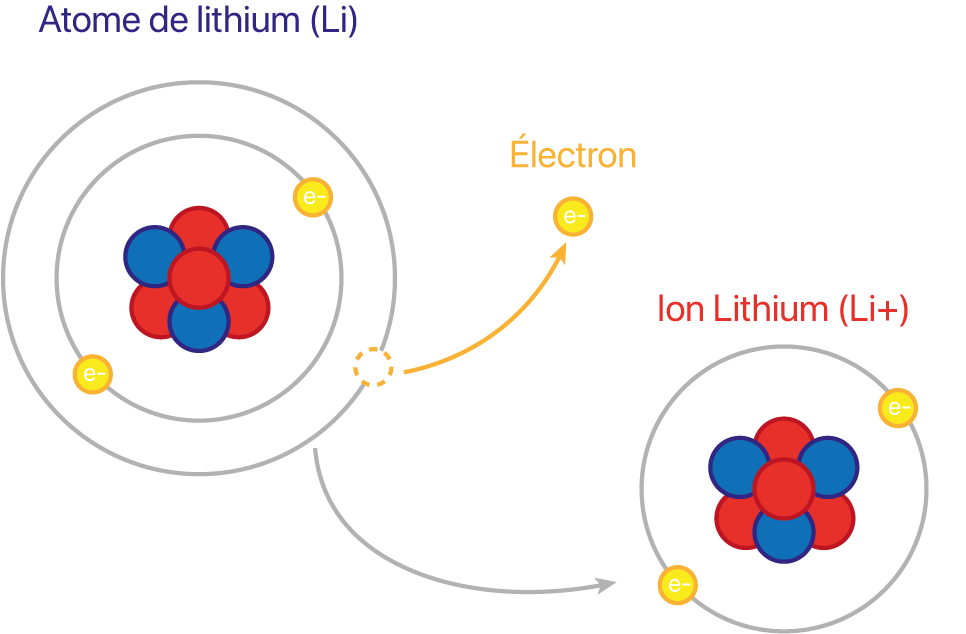
Comment l'ont peu le voir sur la photo ci-dessus, l'atome de lithium fait partie de la catégorie des métaux alcalin (Première colonne du tableau périodique). Il possède le numéro atomique numéro 3 ce qui signifie que sa configuration électronique est la ou . Cette configuration présente un électron célibataire ce qui signifie que pour avoir un configuration électronique la plus stable que possible (correspondant à celle du gaz noble le plus proche) l'atome de Lithium doit perdre un électron pour devenir un ion qui est chargé positivement.
¶ II.2 - Fonctionnement d'une batterie lithium-ion
Une batterie est constituée de deux électrodes, l'une chargée positivement (Cathode) l'autre négativement (Anode). Ces deux électrodes sont séparées par un séparateur et baignent dans une un électrolyte qui est une substance conductrice en raison de la présence d'ions mobiles. Cette électrolyte peut être sont la forme liquide ou solide en fonction des technologies.
Le séparateur laisse passer les ions lithium, mais pas les électrons. Les ions lithium le traversent et rejoingent l'électrode opposée. Les électrons passent par le circuit externe alimentant au passage les appareils électroniques connectés entre les deux électrodes.
De manière générale les accumulateurs lithium utilisent deux matériaux d'insertion pour la composition de leurs électrodes :
- Un oxide de métal de transition lithié à l'électrode positive (LiCoO2, NMC, NCA)
- Du graphite à l'électrode négative.
D'autres matériaux sont actuellement à l'étude et représente une alternative potentiellement viable aux matériaux de référence.

- Lorsque la batterie est totalement chargée les atomes de lithium sont emmagasinés dans le graphite de l'électrode négative,
- Lors de la décharge, les atomes de lithium perdent un électron. Des ions se forment,
- Le séparateur laisse passer les ions mais pas les électrons. Les ion lithium rejoigent la cathode,
- Les électons passent par le circuit électrique alimentant l'appareil et lui permettant de fontionner,
- Dans la cathode l'oxide de métal chargé positivement attirent les électrons et les ions lithium.
- Lorsque tous les ions lithium sont passés côté cathode, la batterie est déchargée.
Le processus décrit par les 6 points énoncés précédement est réversible. Un chargeur pousse les ions lithium et les électrons à effectuer le chemin inverse. Ils retrouve ainsi l'anode et leurs états initial.
¶ II.3 - Fabrication des accumulateurs Lithium
L'accumulateur est fabriqué à l'état complètement déchargé, l'électrode positive étant la source de lithium, et le graphite de l'électrode négative étant initialement vide d'ion lithium. Lors de la première charge, les ions lithiums sont extraits de l'électrode positive, diffusent à travers l'électrolyte et le séparateur pour se loger dans l'électrode négative de graphite. Afin de respecter la règle de l'électronégativité, pour chaque passage d'un ion Li+ dans le circuit interne de la batterie un électron traverse le circuit externe de la batterie. Le phénomène inverse se produit lors de la décharge.
Il est à noter que lors de la première charge, une couche de passivation, dites SEI pour Solid Electrolyte Interphase, se forme sur l'électrode négative de graphite. Cette couche de passivation permet une bonne tenue en cyclage de l'accumulateur. Sa formation conduit cependant à une perte de capacité irréversible de l'ordre de 5% à 10%.
¶ III - Analyse des performances
Pour analyser la porformance d'un système de stockage d'énergie électrique les caractéristiques suivantes sont citées :
- La puissance maximale qu'il est en mesure de fournir
- La capacité d'énergie pouvant être stockée
- Ses dimensions
- Son poids
Deux grandeurs permettent de regrouper trois des quatres caractéristiques citées : La puissance spécifique qui permet de définir la puissance par unité de masse et l'énergie spécifique qui permet de définir la puissance par unité de masse. La densité permet de relier la masse au volume de l'accumulateur.
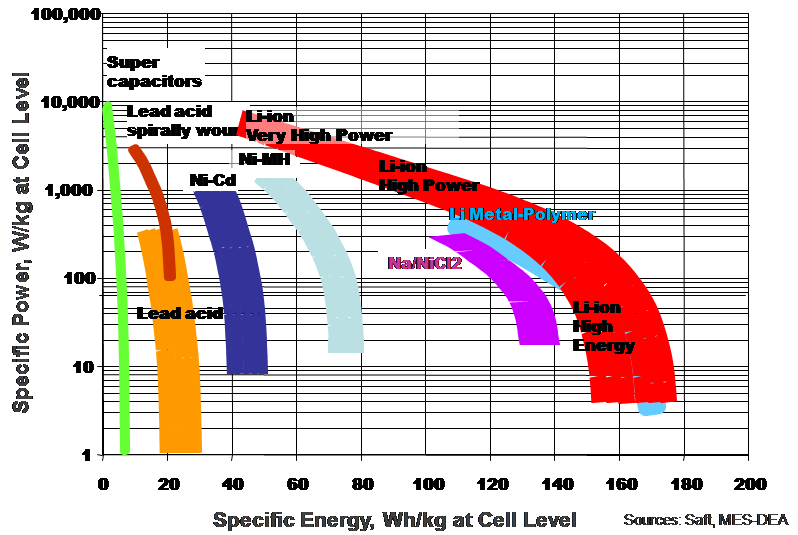
Pour comparer les différentes technologies d'accumulateurs, il est généralement utilisé les grandeurs d'énergie spécifique (Wh/kg ou Wh/L) et/ou de puissance spécifique (W/kg) et ce notamment pour les systèmes embarqués ou la masse du système de stockage est un paramètre critique. Le diagramme de Ragone représente la répartition des familles d'accumulateurs en fonction de ces deux indicateurs. Ce diagramme est particulièrement utile pour un sélection préliminaire des systèmes de stockage pour un système standard ou hybride destinée à une application embarquée.
Les performances des accumulateurs sont évidemment aussi mesurées en utilisation, c'est-à-dire par exemple, lors de cyclage de charge et décharge. Pour les caractériser, il est fréquent de reporter l'évolution de la tension aux bornes de la cellule en fonction de la capacité déchargée, exprimée en ampère heure (Ah), et ce pour diverses valeurs de courant. Un exemple est représenté sur le figure suivante pour le cas d'un accumulateur cylindrique de format 18650 pour des courants allant de 0.2C ou C5 (C/5) fois le régime nominal à 2C. C correspond au C-Rate qui correspond au régime nominal de l'accumulateur. Il correspond au courant permettant de décharger ou charger l'accumulateur entièrement en une heure. Il permet de normaliser le courant en fonction de la capacité de stockage de la batterie.
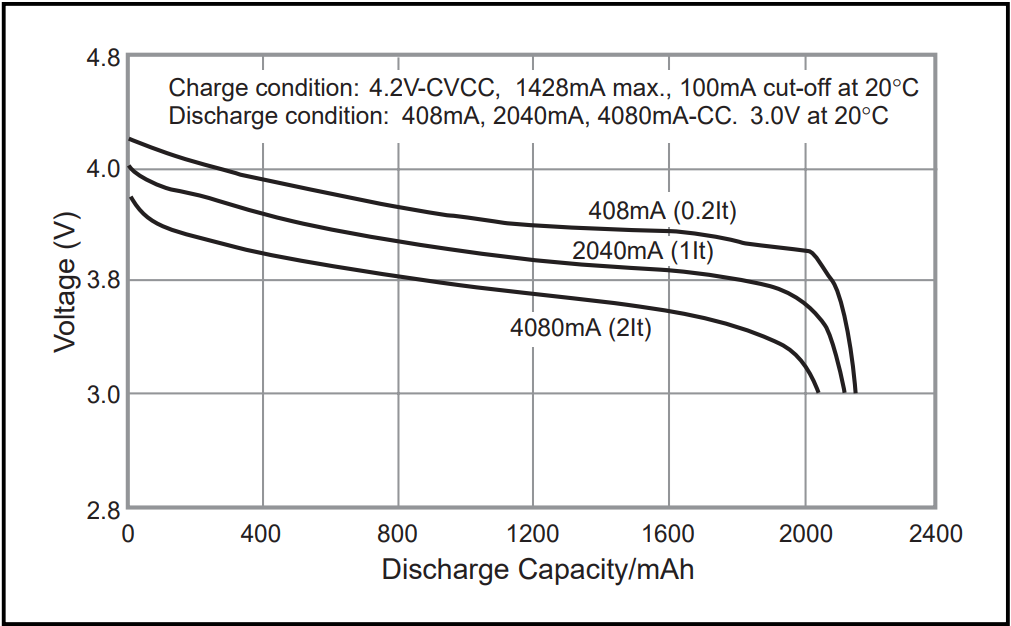
Concrètement, l'accumulateur pris en exemple présente une capacité de stockage de 2040 mAh, soit un régime nominal de 2040 mA. Une décharge rapide à 4080mA correspond à 2C et dure environ 30 minutes au cours de laquelle la capacité nominale de 2040mAh est récupérée. À régime plus lent, par exemple C/5, ou 408mA, la capacité récupérée est proche de 2200 mAh. Les courbes mettent en évidence une diminution sensible de la tension moyenne lors de l'augmentation du régime de décharge. Cette différence provient des phénomènes ohmiques ou de diffusion au sein de l'accumulateur.
Il faut également garder à l'esprit que les accumulateurs sont les cellules élémentaires constituant les batteries dans lesquelles ils sont associés en série et/ou en parallèle afin d'augmenter la tension ou la capacité de fonctionnement de la batterie. Avec cette association, il est également ajouté une électronique de puissance appelée BMS (Battery Management System). Le pack ainsi formé par l'assemblage de cellules et de l'électronique de puissance est couramment appelé "Pack Batterie".
À l'issue de 150 années de développement, seules quatre principales technologies d'accumulateurs ont connu une large diffusion dans le domaine grand public. Les accumulateurs Li-ion prennent aujourd'hui une part de marché de plus en plus grande grâce à leur versatilité, leurs performances et leur coût qui continue à diminuer rapidement. Simultanément, face au défi constitué par le développement à grande échelle du véhicule électrique, et face à celui posé par le stockage stationnaire, de nombreuses voies de progrès continuent à être explorées, soient pour améliorer les performances des batteries lithium-ion, soit de développer des options alternatives - Lithium-soufre, sodium-ion, matériaux organiques - moins gourmandes en matériaux sensibles par exemple.